به گزارش ایسنا، چرخه توسعه واکسنها؛ یک فرآیند ۶ مرحلهای شامل مراحل اکتشافی، پیشبالینی (فاز حیوانی)، کارآزمایی بالینی، تایید مجوز، تولید انبوه و کنترل کیفیت است. مراحل اول و دوم (اکتشافی و پیشبالینی) مطالعات در آزمایشگاه انجام میشود و مرحله کارآزمایی بالینی، در سه زیرمرحله انجام میشود.
در مراحل کارآزمایی بالینی یک، دو و سه، واکسنهای طراحی شده به جمعیتهای مختلفی از افراد تزریق میشود تا مشخص شود آیا واکسن طراحی شده، برای انسانها ایمن هستند و میتوانند از آنها در برابر آن بیماری خاص محافظت کنند یا خیر؟
یکی از اقداماتی که گروههای تحقیقاتی برای تکمیل چرخه دانش ملزم به انجام آن هستند، انتشار نتایج تحقیق در قالب مقاله در نشریات علمی است. در نشریات علمی، فرآیندی به نام «بازبینی توسط همتایان» یا peer reviewed وجود دارد که طی آن، نتایج تحقیقات توسط چند نفر از متخصصان در همان زمینه پژوهشی، مورد بررسی قرار گرفته و داوری میشوند تا از انتشار یافتههای غیرقابل اطمینان، جلوگیری شود. به صورت معمول، مقالات تنها پس از انجام داوری و بازبینی توسط همتایان و در صورت داشتن شرایط مورد نیاز میتوانند برای عموم منتشر شوند.
با شیوع کووید-۱۹ در جهان، رقابت برای دستیابی به واکسن آغاز شد و در ایران نیز این تلاشها ادامه یافت. تا کنون در ایران واکسنهای متعددی از جمله واکسن «کووایران برکت»، «اسپایکوژن»، «کووپارس»، «فخراوک»، «نورا» و «پاستوکوآد» با استفاده از پلتفرمها و فناوریهای مختلف توسعه یافتند و مطالعات واکسن «پاستوکووک» نیز با همکاری انستیتو فینلای کوبا انجام شد.
یکی از انتقاداتی که نسبت به واکسنهای ایرانی وجود داشت، عدم انتشار مقاله مراحل مختلف مطالعات واکسنها بود. انتشار مقاله مراحل پیش بالینی واکسن برکت، آبان ماه سال گذشته انجام شد و انتشار مقالات دیگر به تدریج ادامه یافت. مقالات مرحله اول و دوم کارآزمایی بالینی واکسنهای برکت، پاستوکووک و اسپایکوژن در مجلات علمی منتشر شده، ولی هیچ مقالهای از مرحله سوم کارآزمایی بالینی که به بررسی عوارض جانبی نادر و یا طولانیمدت واکسن میپردازد، در دسترس نیست.
مهر ماه سال گذشته، واکسن اسپایکوژن شرکت سیناژن از سوی سازمان غذا و دارو، مجوز مصرف اضطراری دریافت کرد. در روزهای گذشته، مقاله کارآزمایی بالینی فاز سوم واکسن اسپایکوژن در مجله علمی Clinical Microbiology and Infection به صورت Pre-Proof منتشر شده است و از بین واکسنهای ایرانی، اسپایکوژن تنها واکسنی است که مقاله کارآزمایی بالینی فاز سوم خود را منتشر کرده است.

مجله Clinical Microbiology and Infection یک ماهنامه به زبان انگلیسی با ضریب تاثیر ۱۳.۳۱ است که زیر نظر انجمن اروپایی میکروبیولوژی بالینی و بیماریهای عفونی قرار دارد. این مجله، مقالاتی در زمینههای میکروبیولوژی، بیماریهای عفونی و ویروسشناسی منتشر میکند.
فاز سوم مطالعات بالینی واکسن اسپایکوژن در ۱۶ مرداد ۱۴۰۰ و در زمان موج دلتا کووید-۱۹ آغاز شد. بیش از ۱۶ هزار و ۸۰۰ نفر (۱۸ تا ۸۰ سال) دراین مطالعه شرکت کردند و به صورت تصادفی و با نسبت سه به یک، واکسن و دارونما دریافت کردند. به این معنی که از هر چهار نفر؛ سه نفر، واکسن اسپایکوژن و یک نفر دارونما، به صورت دو دوز با فاصله ۲۱ روز دریافت کردند.
به طور کلی ۱۲ هزار و ۶۵۷ نفر و چهار هزار و ۲۱۹ نفر به صورت تصادفی به ترتیب در دو گروه واکسن اسپایکوژن و دارونما قرار گرفتند و به مدت حدود ۵۵ روز پیگیری شدند. ۲.۴درصد از شرکتکنندگان گروه واکسن و ۳.۸ درصد از شرکتکنندگان گروه دارونما، به کووید-۱۹ مبتلا شدند و این موضوع نشاندهنده آن است که واکسن اسپایکوژن حدود ۴۴ درصد اثربخشی (بین ۳۰.۱ تا ۵۵ درصد) داشته است.
از دو هفته بعد از دوز دوم، ۰.۰۵ درصد از شرکتکنندگان گروه اسپایکوژن و ۰.۱۹ درصد از افراد گروه دارونما به کووید-۱۹ شدید مبتلا شدند و این نشان دهنده آن است که اثربخشی این واکسن در برابر بیماری شدید ۷۷.۵۱ درصد (بین ۲۶.۳ تا ۹۳.۱ درصد) است.
همچنین بررسیهای این پژوهش نشان میدهد که عوارض جانبی این واکسن خفیف و کوتاهمدت بودند و در مدت پیگیری، هیچ مرگی در دو گروه واکسن و پلاسبو گزارش نشده است.
این مطالعه با محدودیتهایی نیز مواجه بوده است؛ از جمله اینکه بزرگسالان ۱۸ تا ۵۰ ساله وارد مطالعه شدند و این محدودیتی بوده که کمیته اخلاق برای مطالعات واکسنهایی که در زمان در دسترس بودن واکسنهای دیگر انجام میشدند، اعمال کرده بود.
یافتههای این مطالعه حاکی از این است که واکسن اسپایکوژن اثربخشی قابلتوجهی در برابر کووید-۱۹ ایجاد میکند و همچنین خطر بیماری شدید کووید-۱۹ ناشی از واریانت دلتا را به طور قابل توجهی کاهش میدهد.
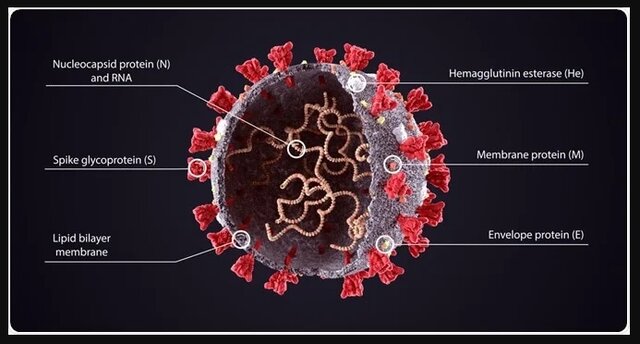
برای طراحی واکسن اسپایکوژن از پلتفرم پروتئین زیرواحد نوترکیب استفاده شده است. در این واکسن خودِ ویروس زنده و یا ویروس کشتهشده استفاده نمیشود و در آن تنها از بخشی از ساختمان ویروس؛ یعنی پروتئین «اسپایک» استفاده میشود.
پروتئین اسپایک (S)، پروتئینی است که در سطح بیرونی ویروس قراردارد و در اتصال و ورود ویروس سارس-کوو-۲ به سلول میزبان نقش کلیدی ایفا میکند. به همین دلیل در برخی واکسنها از این پروتئین برای شناساندن ویروس کووید-۱۹ به بدن استفاده میشود و از این طریق سیستم ایمنی را تحریک میکند.
بعد از تزریق واکسن، اگر ویروس به بدن فرد واکسینه وارد شود، سیستم ایمنی بدن به سرعت فعال شده و با ترشح پادتن و غیرفعال کردن سلولهای آلوده به ویروس، از گسترش آن در بدن جلوگیری میکند.
در انجام این مطالعه پیام طبرسی از مرکز تحقیقات سل و اپیدمیولوژی بالینی پژوهشکده ملی سل و بیماریهای ریوی (NRITLD) دانشگاه علوم پزشکی شهید بهشتی، نسیم انجیدانی، رامین شاهپری، آراز سبزواری، بابک یزدانی، حمیدرضا کافی نیوشا فلاح، علی ابراهیمی علی طاهری و ساغر براتی؛ پژوهشگران گروه پزشکی شرکت ارکیده فارمد، مسعود مردانی از مرکز تحقیقات بیماریهای عفونی و گرمسیری، دانشگاه علوم پزشکی شهید بهشتی و نیکولا پتروفسکی از شرکت خصوصی محدود «Vaccine Pty» استرالیا مشارکت داشتند.
تا کنون پنج مقاله از مطالعات مراحل مختلف واکسن اسپایکوژن در نشریات بینالمللی منتشر شده است و واکسن اسپایکوژن اولین واکسن ایرانی است که مقاله مرحله سوم کارآزمایی بالینی خود را منتشر کرده است.
لازم به ذکر است که این مقاله به صورت Pre-Proof منتشر شده است. مقالات Pre-Proof فرآیند داوری را طی کردهاند و در شمارههای بعدی مجله به صورت رسمی منتشر میشوند و ممکن است در این مدت تغییراتی داشته باشند.
انتهای پیام



نظرات