به گزارش ایسنا و به نقل از نیچر، موفقیت تجاری واکسنهای آرانای برای کووید-۱۹ باعث افزایش علاقه به آرانایهای حلقوی به عنوان نسل بعدی درمانها شده است. اما مدتهاست که میدانیم این فناوری یک نقص کلیدی دارد: آرانای، در شکل خطی معمول خود، عمر کوتاهی دارد و در عرض چند ساعت، آنزیمهای موجود در سلولها به درون مولکول فرو میروند و آن را تکه تکه میکنند.
ماهیت کم عمر آرانای مشکل بزرگی برای واکسنسازی نیست زیرا آرانای تنها به مدت کوتاهی نیاز دارد تا پروتئینها را رمزگذاری کند و پاسخ ایمنی را تحریک کند. اما برای بیشتر کاربردهای درمانی، داشتن آرانای که بتواند برای مدت طولانیتری در بدن بماند، بسیار مفیدتر خواهد بود.
اینجاست که آرانایهای حلقوی ای یا circRNAها وارد عمل میشوند. انتهای رونوشت آرآنای به هم گره زده میشود تا بسیاری از آنزیمهای مولد آرانای جایی برای فرو بردن دندانهایشان نداشته باشند. آرانای به عنوان یک حلقه، پایداری و طول عمری به دست میآورد که از نظر تئوری، میتواند پتانسیل درمانی آن را حتی در دوزهای پایین افزایش دهد.
هاوارد چانگ(Howard Chang)، متخصص ژنتیک مولکولی در دانشکده پزشکی دانشگاه استنفورد در کالیفرنیا و یکی از بنیانگذاران علمی استارتآپ اوربیتال تراپیکس (Orbital Therapeutics) در کمبریج، ماساچوست، میگوید: با یک بار تحویل، میتوانید پروتئین کاملا بادوامی تولید کنید. شرکتهای زیستفناوری اکنون به دنبال درمانهای مبتنی بر آرآنای حلقوی مهندسی شده هستند.
این شرکتهای زیستفناوری در مجموع بیش از یک میلیارد دلار سرمایهگذاری خطرپذیر در سه سال گذشته داشتهاند و بسیاری از شرکتهای بزرگ داروسازی در حال حاضر نیز مشغول به کار بر روی این فناوری هستند. آنها بر این باورند که هر کاری که آرآنای خطی میتواند انجام دهد، همتای حلقوی انعطاف پذیرتر آن میتواند بهتر آن را انجام دهد.
طرفداران این روش پیشبینی میکنند که آرانای حلقوی به عنوان پلتفرمی ارجح نسبت به آرانای در صنعت دارو ظهور کند و بتواند منجر به تولید محصولاتی از نسل بعدی واکسنها گرفته تا درمان بیماریهای نادر، عوامل ضد سرطان و فراتر از آن شود. اولین آزمایش انسانی چنین داروهایی در ماه اوت آغاز شده است.
اما همانطور که یکی از شرکتهای نوپا پیشبینی کرده است، آرانایهای حلقوی هنوز تا آغاز یک انقلاب یا تحقق وعده ۱۰۰ برنامه دارویی جدید تا پایان دهه فاصله زیادی دارند و اینکه آیا انعطافپذیری افزوده شده توسط آرانای حلقوی آن را قادر میسازد تا از دیگر رویکردهای درمانی طولانیمدت مانند ژن درمانیهای مرسوم یا روشهای نوظهور ویرایش ژن پیشی بگیرد.
یک ایده حلقوی
محققان اولین آرانایهای حلقوی را در طبیعت در سال ۱۹۷۶ پیدا کردند، زمانی که گروهی در آلمان مجموعهای از عوامل بیماریزای آرانای کوچک و ویروس مانند را در گیاهان تشریح کردند که شکل بسته و حلقهای داشتند. ۱۵ سال بعد، محققان این مولکولها را در سلولهای انسان و سایر پستانداران شناسایی کردند.
با این حال، تا دهه ۲۰۱۰ طول کشید تا محققان میزان آرانایهای حلقوی شکل در انواع مختلف سلول را درک کنند و نقشهای چندوجهی آنها در هدایت فعالیتهای زیستی را کشف کنند.
در بیشتر موارد، نقش آنها اتصال به مولکولهای تنظیم کننده برای مداخله در بیان ژن است. برخی از آرانایهای حلقوی میتوانند پروتئینها را رمزگذاری کنند. این عملکرد که دانشمندان زود متوجه آن شدند میتواند پتانسیل درمانی داشته باشد، البته اگر راهی برای ساخت آرانایهای حلقوی از ابتدا وجود داشته باشد.
در سلولها، دایرهها از طریق یک حالت غیر متعارف پردازش آرانای پیامرسان به نام «پیرایش برگشتی» به وجود میآیند. به طور معمول، اتصال آرانای بسیار شبیه به ویرایش فیلم عمل میکند و بخشهای غیر کد کننده جدا شده و بخشهای کد کننده باقی مانده به هم متصل میشوند. اما در برخی موارد، آرانای چرخش غیرمنتظرهای پیدا میکند و به سمت خود جمع میشود، فشرده میشود و یک حلقه مستقل تشکیل میدهد.
اتصال به پشت مستلزم حرکات پیچیده بین پروتئینهای مختلف است که همه آنها به طور طبیعی در داخل سلولها وجود دارند اما به راحتی در آزمایشگاه در دسترس نیستند. بنابراین، در اوایل دهه ۱۹۹۰، محققان دو راه حل ممکن برای ایجاد آرانایهای حلقوی مصنوعی ارائه کردند.
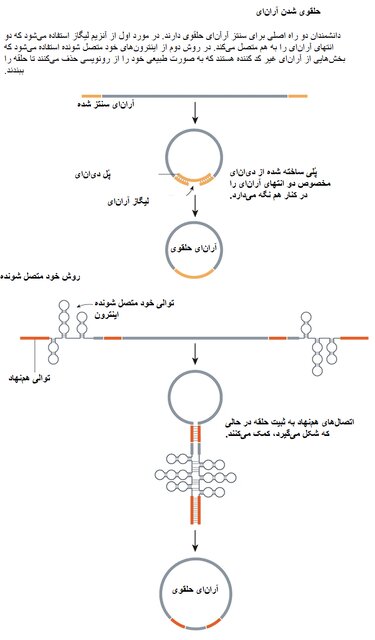
در یکی از این روشها، از پلهای دیانای برای حفظ دو سر یک رشته آرآنای در کنار هم استفاده میشود در حالی که آنزیم دیگری آن را مهر و موم میکند، فرآیندی که به عنوان ligation۳ شناخته میشود. در روش دیگر خواص آنزیمی خود توالیهای آرانای تخصصی مهار میشود. هنگامی که دو توالی این چنینی به شکل سنجاق سر جفت میشوند، میتوانند واکنشهای متقاطعی را آغاز کنند و یک حلقه تشکیل دهند.
در سال ۱۹۹۵، گروهی در دانشگاه کلرادو در دنور، با استفاده از یک توالی تخصصی به نام IRES۶، نحوه سنتز پروتئینها توسط این حلقههای آزمایشگاهی را بررسی کردند.
کلمه IRES که مخفف عبارت محل ورود ریبوزوم داخلی است به ریبوزوم به عنوان ماشین پروتئینسازی سلول، اجازه میدهد تا به رونوشت آرانای حلقوی متصل شود و شروع به تولید مداوم پروتئین کند.
با این حال، محققان تنها میتوانند توالیهای حلقوی کوتاه ایجاد کنند و به طور کلی، به حداکثر چند صد نوکلئوتید دست یابند. برای مدت ۲۰ سال، این زمینه با محدودیت ابعاد دست و پنجه نرم میکرد و تولید رونوشتهای طولانی رمزگذاری پروتئین برای رسیدگی به بیماریهایی مانند فیبروز کیستیک یا هموفیلی غیرممکن بود.
الکس وسلهافت(Alex Wesselhoeft) تصمیم گرفت این موضوع را تغییر دهد.
ساخت حلقهها
وسلهافت به عنوان دانشجوی فارغ التحصیل در موسسه فناوری ماساچوست(MIT) در کمبریج کار خود را با روش ligation شروع کرد، اما ثابت شد که این روش برای حلقههای بزرگتر ناکارآمد است. چالشهای دستیابی به انتهای آرآنای با افزایش اندازه آن بیشتر به چشم میخورد و دستیابی به یک ساختار حلقوی خوب دشوارتر میشود.
وسلهافت با تغییر به رویکرد خودپیرایشی(self-splicing)، رشتههای آرانای را به گونهای طراحی کرد که دارای مناطق کدکننده پروتئین و عناصر IRES باشند که توسط توالیهای خود پیرایش شونده احاطه شدهاند. دیگر محققان نیز همین کار را پیش از این انجام داده بودند. اما با همکاری مهندسان زیستی پیوتر کوالسکی(Piotr Kowalski) در دانشگاه کالج کورک در ایرلند، و دان اندرسون(Dan Anderson) در موسسه فناوری ماساچوست، او تکههای مکمل آرانای و توالیهای فاصلهدهنده را در نقاط مختلف به مولکول اضافه کرد که به تثبیت ساختار سنجاق سری کمک میکند و چرخش به سمت داخل را ممکن میسازد.
این کار تفاوت زیادی ایجاد کرد. آرانای مصنوعی ساخته شده اکنون میتوانست به طور موثری، حتی با توالیهای طولانیتر، به شکل حلقوی در بیاید. آزمایشها روی موشها نشان داد که این آرانایهای حلقوی میتوانند برای چندین روز باعث تولید پروتئین شوند، در حالی که آرانای پیامرسان خطی تنها برای ۲۴ ساعت پروتئین تولید میکند. روشهای حلقویسازی که برای اولین بار در سال ۲۰۱۸ گزارش شد، به سرعت به عنوان روشی پیشرو برای سنتز آرانای حلقوی آزمایشگاهی معرفی شد.
جیسون راوش(Jason Rausch)، بیوشیمیدان آرانای در مؤسسه ملی سرطان ایالات متحده در فردریک، مریلند، که این روش را برای پروژه آرانای حلقوی خود اتخاذ کرد، میگوید: این واقعا کارها را کارآمدتر کرد.
در سال ۲۰۱۹، وسلهافت و اندرسون به همراه رافائلا اسکوئیلونی(Raffaella Squilloni)، که یک کارآفرین زیستفناوری است، شرکتی را برای تجاریسازی این پلتفرم تاسیس کردند. نام این استارتآپ که در ابتدا از روی ماری افسانهای که حلقهای برای بلعیدن دم خود میسازد، «Oroboros Bio» نامگذاری شده بود، بعدها به اورنا تراپیکس(Orna Therapeutics) تغییر کرد.
وسلهافت به عنوان رئیس زیستشناسی مولکولی در اورنا، به پالایش و بهینهسازی این فرآیند ادامه داد. در نهایت، او یک circRNA فوقالعاده طولانی ساخت که دیستروفین را کد میکند. دیستورفین پروتئین بزرگی است که مبتلایان به «دیستروفی عضلانی دوشن» دچار کمبود آن میشوند. رونوشت این آرانای حاوی نزدیک به ۱۲۰۰۰ نوکلئوتید بود. وسلهافت میگوید دیستروفین، بزرگترین مورد در ژنوم انسان است که بخواهید بیان کنید.
با این حال، اورنا تنها استارت آپی نبود که صنعت آرانای حلقوی خود را تقویت کرد. دیگر شرکتها رویکردهای متفاوتی برای ساخت آرانای حلقوی اتخاذ کردهاند.
برخی از شرکتها دستورالعملهای تولید آرانای حلقوی را در ناقلهای ویروسی یا کاسِتهای دیانای قرار داده و سپس اجازه میدهند که پیوند در سلول اتفاق بیفتد. آراویند آسوکان(Aravind Asokan)، ویروس شناس مصنوعی در دانشگاه دوک در دورهام، کارولینای شمالی، و یکی از بنیانگذاران Torque Bio در پارک تحقیقاتی تراینگل، کارولینای شمالی، میگوید: ویروس ما در اینجا کار سخت را برای ما انجام میدهد و در واقع حلقه را از درون هسته میسازد.
شرکت دیگری به نام چیمرنا تراپیکس(Chimerna Therapeutics) در شهر نیویورک، از باکتریهای دستکاری شده ژنتیکی برای ساخت آرانای حلقوی خود استفاده میکند، به گونهای که برایان پیکرینگ(Brian Pickering)، مدیر اجرایی آن میگوید در مقایسه با مولکولهای کاملا تولید شده در آزمایشگاه، صرفهجویی زیادی در هزینه و زمان میکنند.
با این حال بیشتر استارتآپها بر اساس پروتکل وسلهافت کار میکنند. در ماه اوت، گروهی در شرکت زیستفناوری رزونومیکس(Rznomics) در سئونگنام، کره جنوبی، سیستمی را برای حلقوی کردن آرانای توصیف کردند که از باقی ماندن هرگونه توالی خودپیچیده ناخواسته در آرانای حلقوی جلوگیری میکند.
محققان دو شرکت در چین با نامهای سیرکود بابومدیسن(CirCode Biomedicine) در شانگهای و سوژو کرمد تکنولوژی(Suzhou CureMed Biopharma Technology) به طور جداگانه پیش چاپهایی از مقالات را در سال گذشته منتشر کردند که رویکردهای مشابهی را ترسیم میکرد.
چیجیان زو(Chijian Zuo)، رئیس تحقیق و توسعه در سوژو کرمد، میگوید: آرانای حلقوی نهایی تنها شامل منطقه کدکننده و IRES خواهد بود و هیچ دنباله یا مصنوع ناخواستهای ندارد.
بحثها در مورد آرانای حلقوی
حذف این قطعات اضافی از توالی ممکن است تضمین کند که آرانایهای حلقوی پاسخهای ایمنی نامطلوب را که میتواند کارایی درمانی آنها را تضعیف کند، تحریک نمیکنند.
توماس کرکگارد جنسن(Thomas Kirkegaard Jensen)، یکی از مدیران اجرایی شرکتی که هدف آن درمان اختلالات ژنتیکی نادر با آرانای حلقوی است به نام آلوپ تراپیکس (Aloop Therapeutics) در کپنهاگ، میگوید: اگر میخواهید درمانی داشته باشید که بارها و بارها در طول زندگی انجام شود، این موضوع اهمیت دارد. ما واقعا باید هر عنصری که به پاسخ ایمنی نامناسب منجر میشود را در نظر بگیریم و سعی کنیم تا آنجا که میتوانیم آن را کاهش دهیم.
با این وجود گزارشها در مورد اینکه آیا آرانایهای حلقوی باعث ایجاد پاسخ ایمنی میشوند یا خیر متفاوت است. لینگ لینگ چن(Ling-Ling Chen)، زیستشناس آرانای در موسسه بیوشیمی و زیستشناسی سلولی شانگهای، میگوید: این واقعا بستگی به نحوه ساخت حلقهها دارد.
در مقالهای که برای اولین بار در سال ۲۰۲۱ به صورت آنلاین منتشر شد، او و همکارانش توضیح دادند که چگونه توالیهای به جا مانده از نقشمایه خود پیچ خورنده تمایل به چینخوردگی آرانای دارند و در نتیجه حلقههایی با ساختارهای نامنظم ایجاد میشوند که باعث واکنش ایمنی میشوند.
با این حال، تقریبا در همان زمان، اولیور روسباخ(Oliver Rossbach)، بیوشیمیدان آرانای و همکارانش در دانشگاه Justus Liebig در گیسن در آلمان گزارش دادند که احتمالاً آلایندهها عامل این امر هستند و این واکنشها را میتوان با مراحل تصفیه صحیح به حداقل رساند یا از بین برد. راسباخ می گوید: باید فوقالعاده تمیز باشد.
با این حال، در برخی موارد، واکنش ایمنی میتواند مطلوب باشد. برای واکسنها هم برای سرطان و هم برای بیماریهای عفونی، تحریک سیستم ایمنی میتواند تولید آنتی بادیها و سلولهای T را تحریک کند. این چیزی است که ونشنگ وی(Wensheng Wei)، دانشمند ویرایش ژنوم در دانشگاه پکن و همکارانش زمانی که واکسنی برای ویروس کرونا سارس-کوو-۲ با استفاده از آرانای حلقوی ساختند، کشف کردند.
در آزمایشها روی موش و میمون، واکسن آرانای حلقوی باعث تولید آنتیبادیهای تخریبکننده ویروس و پاسخ سلول T بیشتری نسبت به واکسن خطی ساختهشده از همان نوع آرانای پیامرسان اصلاحشده، شد که در واکسنهای تأیید شده کووید-۱۹ وجود داشتند. به عنوان یک امتیاز اضافی، جابجایی آرانای حلقوی در دمای محیط پایدارتر از آرانای پیامرسان بود و به طور بالقوه این اجازه میداد واکسن بدون نیاز به زنجیره سرمایی ذخیره و حمل شود.
شرکتی که وی تأسیس کرد، استارتآپ ترونا(Therorna)، اکنون این واکسن را روی افراد آزمایش میکند. تصور میشود این کارآزمایی اولین آزمایشی باشد که داروی مصنوعی آرانای حلقوی در آن بر روی انسان آزمایش میشود. سال آینده ممکن است تعداد انگشت شماری از آنها وارد درمانگاهها شوند، از جمله یک داروی سرطان درمانی از سوگو کر مد که یک مولکول محرک سیستم ایمنی به نام اینترلوکین-۱۲ را رمزگذاری میکند.
اورنا همچنین در حال آماده شدن برای شروع آزمایشات یک آرانای حلقوی در سال ۲۰۲۴ است که سلولهای ایمنی را برای حمله به سرطان خون برنامهریزی مجدد میکند. در کنفرانسی در ماه مه، دانشمندان اورنا نشان دادند که این گزینه، حتی زمانی که در دوزهای پایین تجویز شود، میتواند تومورها را در مدل موش سرطان خون ریشه کن کند، بدون اینکه مهندسی سلولی پیچیده یا رژیمهای دارویی آمادهسازی شدید مورد نیاز برای اکثر درمانهای ایمنی قابل مقایسه در دسترس باشد.
اولویتهای حلقوی
آرانای حلقوی مصنوعی میتواند کارهایی بیشتر از رمزگذاری پروتئینهای درمانی انجام دهد. زمانی که مولکولها به شکلهای خاصی تا شوند، میتوانند مانند آنتیبادیها عمل کنند و مستقیما به اهداف متصل شوند و نوعی دارو به نام آپتامر بسازند. آنها میتوانند انواع مختلفی از مولکولهای تنظیمکننده را جذب و توالییابی کنند و به طور موثر آنها را از محیط سلولی پاک کنند.
آنها همچنین میتوانند به عنوان «عوامل ضد حساسیت» عمل کنند که به رونوشتهای ژنی متصل میشوند و بیان آنها را مسدود کرده یا تغییر میدهند. علاوه بر این، آنها میتوانند به عنوان مولکولهای راهنما برای کاربردهای ویرایش آرانای عمل کنند و آنزیمهای تخصصی را به سمت رونوشتهای ژن بیماری جهش یافته که نیاز به اصلاح دارند هدایت کنند. همه این برنامهها به طور فعال توسط شرکتهای نوپا مختلف بررسی میشود.
بزرگترین سرمایهگذاریها در بیان پروتئین است و بسیاری از تحقیقات و توسعههای اولیه بر یافتن راههایی برای بهبود کارایی تولید پلتفرم آرآنای حلقوی متمرکز شدهاند. زفنگ وانگ(Zefeng Wang)، یکی از بنیانگذاران سیرکود، زیستشناس آرانای در موسسه زیست شناسی محاسباتی در شانگهای میگوید: اگر به اندازه کافی بهینهسازی کنید، میتواند قویتر باشد.
برای اکثر تیمهای تحقیقاتی، این فرآیند با IRES شروع میشود. برای مثال، در نتایجی که اولین بار در سال گذشته منتشر شد، چانگ و همکارانش به طور سیستماتیک دهها عنصر IRES را از ویروسهای مختلف شناسایی کردند و بسیاری از آنها را کشف کردند که بیان پروتئین قویتری را نسبت به مواردی که معمولا در جامعه علمی مورد استفاده قرار میگیرند، ممکن میسازند. با تنظیم دقیق چند عنصر طراحی دیگر، آنها همچنین با موفقیت بهرهوری آرانای حلقوی را تا چند صد برابر افزایش دادند که منجر به حفظ سطح پروتئین برای چندین روز شد.
پیشرفت به شکلی مناسب آغاز شده است و همانطور که این حوزه به بلوغ میرسد با دردسرهای فزایندهای روبرو میشود.
در ماه ژوئن، اخباری در مورد مسائل مربوط به یکپارچگی داده در لاروند(Laronde)، یکی از استارتآپهای پرهزینه در این زمینه منتشر شد. این شرکت مستقر در سامرویل، ماساچوست، مجبور شد در نتیجه یکی از پیشرفتهترین برنامههای دارویی خود را کنار بگذارد.
حلقهها و خطوطها تنها راههای رمزگذاری درمانهای مبتنی بر آرانای نیستند. بسیاری از محققان استدلال میکنند که حتی فناوریهای ماندگارتر، مانند آرانایهای خودتقویتشونده که میتوانند خود را در سلول کپی کنند، برای تبدیل آرانای مصنوعی به یک درمان مناسب برای بسیاری از بیماریهای مزمن ضروری هستند.
وسلهافت که اکنون مدیر درمان آرانای در موسسه ژن و سلول درمانی مسجنرال بیرگام(Mass General Brigham) در کمبریج است، همچنان نسبت به مولکولهای حلقوی خوشبین است. با وجود موفقیت واکسنهای آرانای پیامرسان خطی، او آرآنای حلقوی را آیندهدار میداند.
انتهای پیام


نظرات